

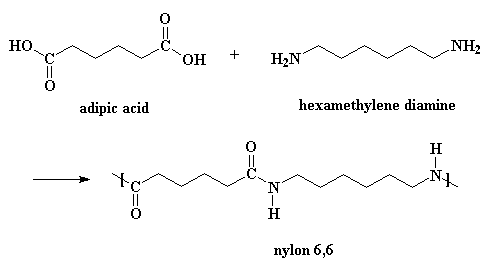
Obviamente, existen más detalles de la reacción de los que usted ve en esa pequeña figura.
Para hacer nylon 6,6 no se necesitan catalizadores, ya que los ácidos catalizan la reacción y créase o no, uno de los monómeros es precisamente un ácido. Entre dos moléculas de ácido adípico ocurre una pequeña reacción. Una le dona un protón al oxígeno del carbonilo de la otra.
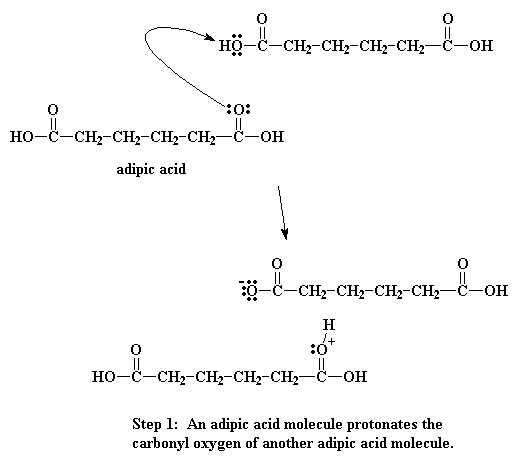
Cuando el oxígeno del carbonilo es protonado, se vuelve mucho más vulnerable al ataque del nitrógeno de nuestra diamina. Esto ocurre porque el oxígeno protonado porta una carga positiva. Al oxígeno no le gusta tener una carga positiva. Entonces atrae hacia sí mismo los electrones que comparte con el carbonilo. Esto deja al carbono del carbonilo deficiente de electrones y listo para que el nitrógeno de la amina le done un par:
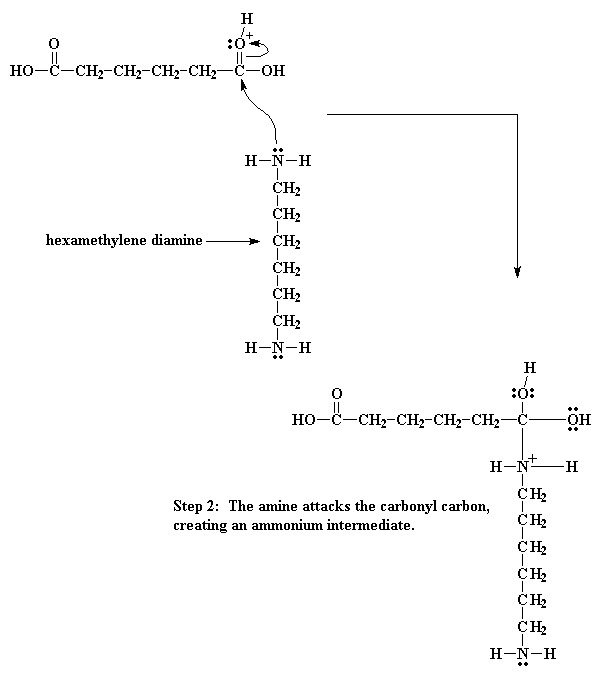
Entonces los electrones hacen su juego. Uno de los pares del doble enlace del carbonilo se desplaza totalmente hacia el oxígeno, haciéndose cargo del problema de la carga positiva sobre ese átomo, pero ahora el nitrógeno queda con una carga positiva.
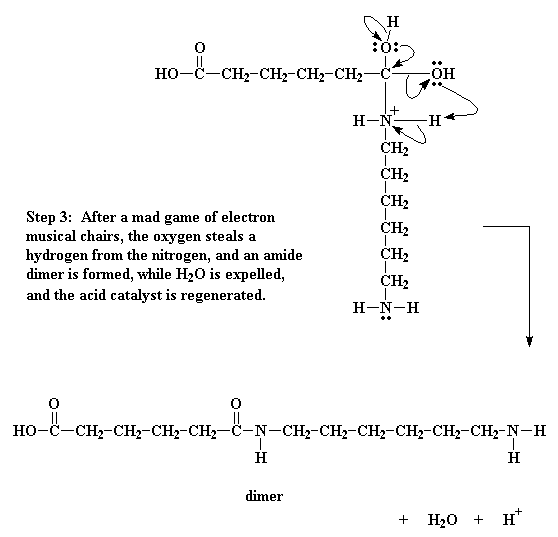
Por lo tanto obtenemos un juego electrónico aún más elaborado. Los electrones provenientes del enlace oxígeno - hidrógeno, vuelven al oxígeno liberando el protón y regenerando el catalizador ácido. Entonces el oxígeno del carbonilo comparte sus nuevos electrones con el átomo de carbono, regenerando el doble enlace del carbonilo.
De hecho, no es suficiente. El oxígeno del grupo hidroxilo decide por su cuenta, hacer un pequeño reordenamiento de electrones. Toma el par que comparte con el carbono y lo acapara para sí mismo, rompiendo el enlace entre él y el carbono. Luego dona un par de electrones al hidrógeno unido al nitrógeno.
Esto hace que el hidrógeno se ponga a pensar. Ya que ahora comparte un par electrónico con el oxígeno, se da cuenta que no es necesario mantener el par que comparte con el nitrógeno, de modo que deja escapar dicho par, dándoselo al nitrógeno. Este desplazamiento de electrones rompe el enlace entre el hidrógeno y el nitrógeno y elimina la carga positiva sobre ese nitrógeno. Se libera H2O y se genera un dímero conteniendo un enlace amida.
¿Qué hace este dímero? Fíjese bien y verá que tiene un grupo ácido en un extremo y un grupo amino en el otro. Esto significa que puede reaccionar con una molécula del diácido o una molécula de la diamina. Sea como fuere, usted obtiene un trímero.
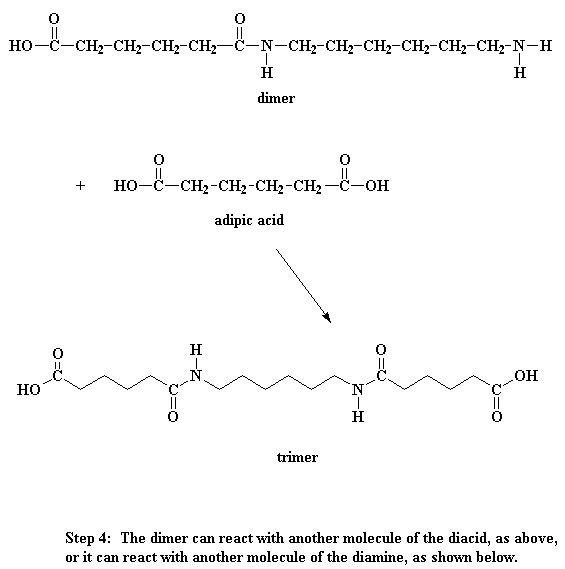
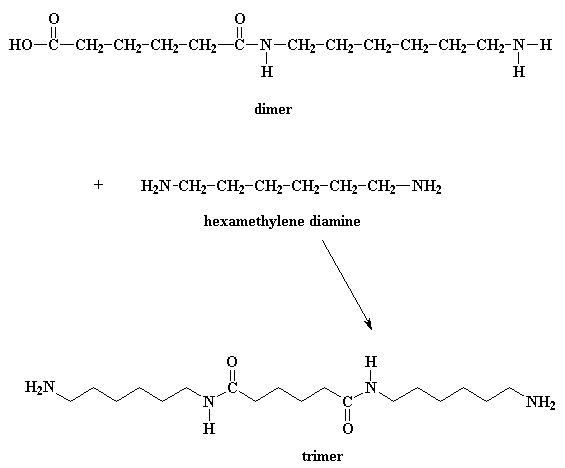
¿Quiere saber un pequeño secreto? Nuestro dímero, si lo desea, también puede reaccionar con otros dímeros para formar un tetrámero. O puede reaccionar con un trímero para formar un pentámero y a su vez reaccionar con oligómeros más grandes. Finalmente, cuando ésto sucede, los dímeros se transforman en trímeros, tetrámeros y oligómeros más grandes y estos oligómeros reaccionan entre sí para formar oligómeros aún más grandes. Esto sigue así hasta que se hacen lo suficientemente grandes como para ser considerados polímeros.
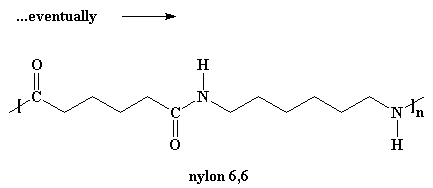
Para que las moléculas crezcan lo suficiente como para ser consideradas polímeros, tenemos que hacer esta reacción bajo vacío. En este caso, todo el subproducto agua se evaporará y será eliminado del medio de reacción. Debemos deshacernos del agua debido a una pequeña regla llamada Principio de Le Chatelier.
¿Recuerda que al comienzo de esta lección, dije que la reacción no necesita un catalizador ácido para llevarse a cabo? La razón por la que sabemos ésto, es que cuando nos acercamos al final de la polimerización, donde no hay muchos grupos ácidos remanentes para comportarse como catalizadores, la reacción aún prosigue. Es decir, la amina puede reaccionar con los ácidos carboxílicos no protonados. Si no fuera así, no se podría obtener nylon 6,6 de alto peso molecular sin un catalizador externo, ya que la reacción se detendría a conversiones más altas, cuando no haya suficientes grupos ácidos para actuar como catalizadores.
¿Quiere saber algo más?
Los nylons también pueden obtenerse a partir de una diamina y un dicloruro de ácido:
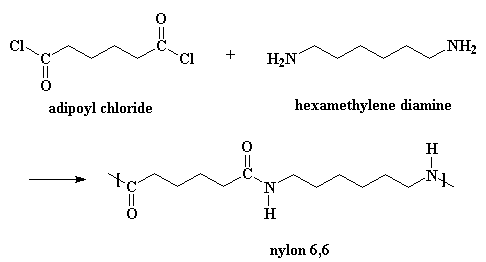
Esta reacción sigue el mismo mecanismo, pero aquí sí se necesita agregar trazas de ácido que actúen como catalizador. (Cuando usted obtiene nylon de la otra forma, el ácido adípico actúa como catalizador). Además, se produce HCl gaseoso como subproducto, en lugar de agua. Si desea ver una animación de este método, haga clic aquí.
 Volver a la Página del Nylon
Volver a la Página del Nylon
 Volver al Directorio del Nivel Cuatro
Volver al Directorio del Nivel Cuatro Volver al Directorio de Macrogalleria
Volver al Directorio de Macrogalleria