 Palabras claves
Palabras clavesUna de las reacciones más comunes y útiles para la obtención de polímeros, es la polimerización por radicales libres. Se emplea para sintetizar polímeros a partir de monómeros vinílicos, es decir, pequeñas moléculas conteniendo dobles enlaces carbono-carbono. Entre los polímeros obtenidos por polimerización por radicales libres tenemos el poliestireno, el poli(metacrilato de metilo, el poli(acetato de vinilo) y el polietileno ramificado. Como introducción, ya hemos hablado demasiado. ¿Qué es esta reacción y en qué consiste?

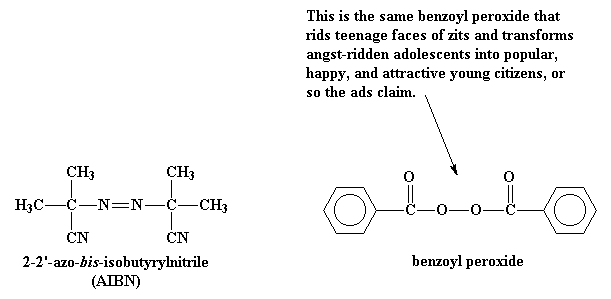
Todo el proceso comienza con una molécula llamada iniciador. Este puede ser por ejemplo el peróxido de benzoilo o el 2,2'-azo-bis-isobutirilnitrilo (AIBN). Lo que hace especial a estas moléculas, es que poseen la inexplicable habilidad de escindirse de un modo bastante inusual. Cuando lo hacen, el par de electrones del enlace que se rompe, se separa. Esto es extraño, dado que siempre que sea posible, los electrones tienden a estar apareados. Cuando ocurre esta escisión, nos quedamos con dos fragmentos llamados fragmentos de iniciador, provenientes de la molécula original, cada uno con un electrón desapareado. Las moléculas como éstas, con electrones desapareados reciben el nombre de radicales libres.
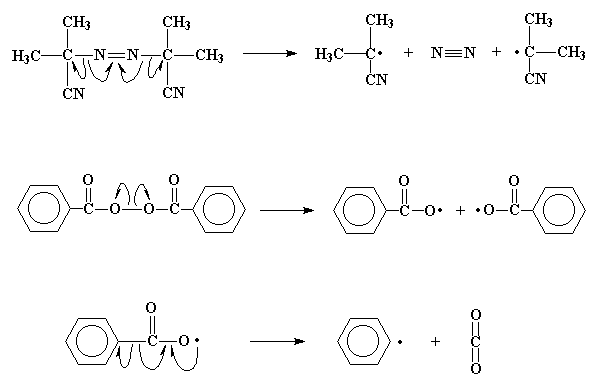
Sin embargo, estos electrones desapareados no se sentirán cómodos estando aislados y tratarán de aparearse. Si son capaces de encontrar CUALQUIER electrón con cual aparearse, lo harán. El doble enlace carbono-carbono de un monómero vinílico como el etileno, tiene un par electrónico susceptible de ser fácilmente atacado por un radical libre. El electrón desapareado, cuando se acerca al par de electrones, no puede resistir la tentación de robar uno de ellos para aparearse. Este nuevo par electrónico establece un nuevo enlace químico entre el fragmento de iniciador y uno de los carbonos del doble enlace de la molécula de monómero. Este electrón, sin tener dónde ir, se asocia al átomo de carbono que no está unido al fragmento de iniciador. Y usted podrá comprobar que ésto nos conduce a la misma situación con la que comenzamos, ya que ahora tendremos un nuevo radical libre cuando este electrón desapareado venga a colocarse sobre ese átomo de carbono. El proceso completo, desde la ruptura de la molécula de iniciador para generar radicales hasta la reacción del radical con una molécula de monómero, recibe el nombre de etapa de iniciación de la polimerización.
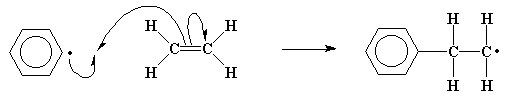
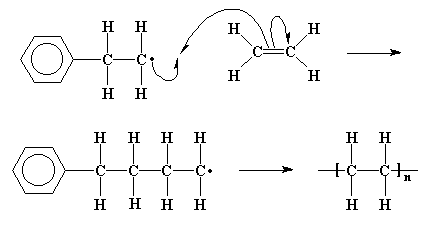
Créase o no, este nuevo radical reacciona con otra molécula de etileno, del mismo modo que lo hizo el fragmento de iniciador. De hecho, como usted puede apreciar, ésto no nos lleva a ninguna parte en cuanto al apareamiento de los electrones, ya que cuando esta reacción toma lugar una y otra vez, siempre formamos otro radical.
El proceso de adicionar más y más moléculas monoméricas a las cadenas en crecimiento, se denomina propagación.
Puesto que seguimos regenerando el radical, podemos continuar con el agregado de más y más moléculas de etileno y constituir una larga cadena del mismo. Las reacciones como éstas que se auto-perpetúan, son denominadas reacciones en cadena. Por lo tanto, mientras la cadena siga creciendo, ¿a quién le importa que haya unos pocos electrones desapareados?
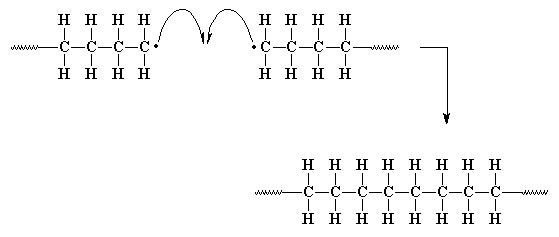
Lamentablemente, a los electrones sí les importa. Los radicales son inestables y finalmente van a encontrar una forma de aparearse sin general un nuevo radical. Entonces nuestra pequeña reacción en cadena comenzará a detenerse. Esto sucede de varias maneras. La más simple consiste en que se encuentren dos cadenas en crecimiento. Los dos electrones desapareados se unirán para formar un par y se establecerá un nuevo enlace químico que unirá las respectivas cadenas. Esto se llama acoplamiento.
El acoplamiento es una de las dos clases principales de reacciones de terminación. La terminación es la tercera y última etapa de una polimerización por crecimiento de cadena. De hecho, iniciación y propagación son las dos primeras.
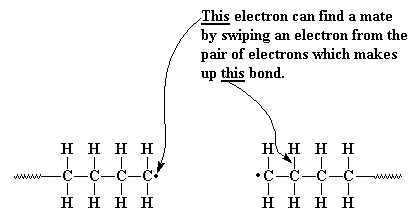
Ahora aquí viene la otra reacción de terminación:
Otra forma en la que nuestro par electrónico puede concluir la polimerización es por desproporción. Esta es una manera bastante complicada en la cual dos cadenas poliméricas en crecimiento resuelven el problema de sus electrones desapareados. En la desproporción, cuando los extremos de dos cadenas en crecimiento se acercan, el electrón desapareado de una de ellas hace algo extraño. En lugar de unirse al electrón desapareado de la otra cadena, busca un compañero en cualquier parte. Encuentra uno en el enlace carbono-hidrógeno del átomo de carbono vecino al otro carbono radical. De modo que nuestro electrón desapareado no sólo toma uno de los electrones de este enlace, sino también el átomo de hidrógeno. Ahora, nuestra primera cadena no tiene electrones desapareados, el carbono terminal comparte ocho electrones y todo el mundo está contento.
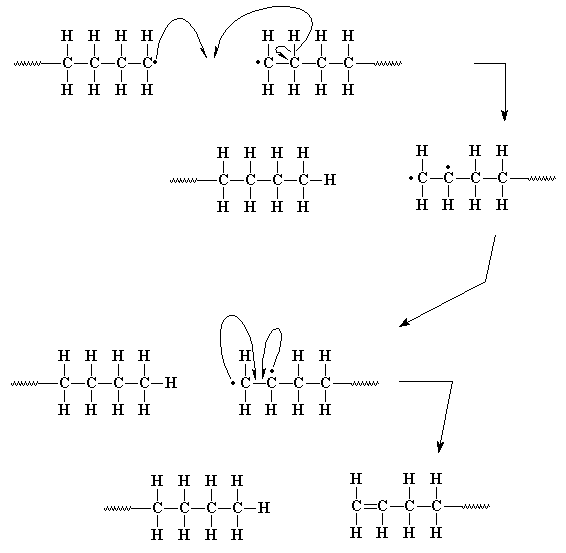
La que no está contenta es la cadena polimérica que pierde su átomo de hidrógeno. No sólo posee ahora un átomo de carbono con un electrón desapareado, ¡sino dos! Pero aunque parece un gran problema, en realidad no lo es tanto. Los dos carbonos radicales, siendo vecinos, pueden unir fácilmente sus electrones desapareados para formar un par y por lo tanto un enlace químico entre ambos átomos de carbono. Como éstos ya compartían un par electrónico, el segundo par creará un enlace doble en un extremo de la cadena polimérica.
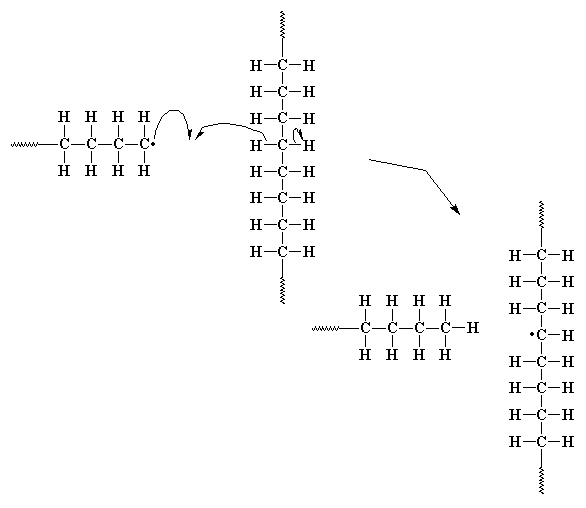
A veces, el electrón desapareado en el extremo de la cadena se encuentra tan incómodo, que se aparea con un electrón de un enlace carbono-hidrógeno de otra cadena polimérica. Esto deja un electrón desapareado en el medio de la cadena que no puede formar un doble enlace terminal como el electrón del último ejemplo, pero sí puede y de hecho lo hace, reaccionar con una molécula de monómero, del mismo modo que lo hace el fragmento de iniciador. ¡Esto origina una nueva cadena creciente en la mitad de la primera cadena! Se llama transferencia de cadena al polímero y da lugar a un polímero ramificado. Esta reacción constituye un problema en el polietileno, tan grave que es imposible obtener polietileno lineal no ramificado por polimerización por radicales libres.
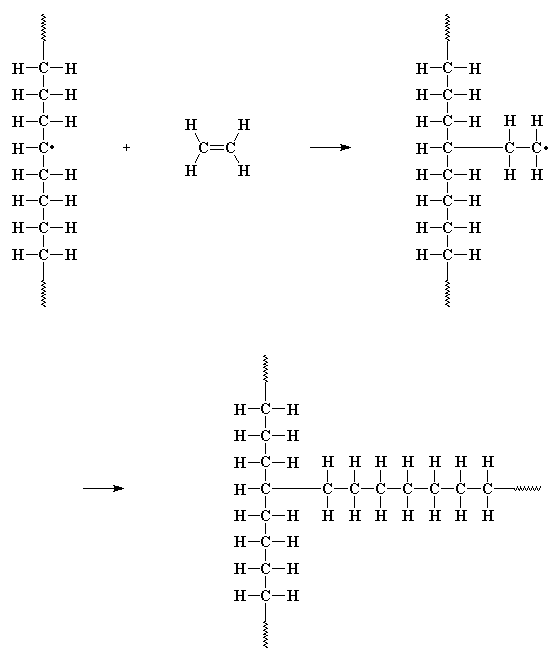
Estas ramificaciones ejercen un notable efecto en el comportamiento del polietileno. Para enterarse de eso y de cómo el hecho de librarse de la ramificación ayudó a hacer un polietileno mejor que el Kevlar en los chalecos a prueba de balas, visite la divertida y profusa página del polietileno.
 Volver al Directorio del Nivel Cuatro
Volver al Directorio del Nivel Cuatro Volver al Directorio de Macrogalleria
Volver al Directorio de Macrogalleria