Mais avant que nous parlions plus, du poids moléculaires, commençons par une question :
Pourquoi les polymères rendent-ils les solutions visqueuses ?
D'une part, les molécules de polymères se déplacent très lentement, tout au moins, elles se déplacent beaucoup plus lentement que le font de petites molécules. Cela signifie logiquement que plus les molécules se déplacent rapidement, plus le liquide sera fluide. De ce fait, lorsque nous dissolvons un polymère dans un solvant, les mouvements lents des molécules du polymère vont rendre l'ensemble de la solution, plus visqueuse.
Ok, les polymères sont lents. Mais pourquoi toute la solution devient-elle visqueuse ? Les molécules de polymères rendent-elles celles du dissolvant plus lentes aussi ? Comment ?
La réponse est oui. Les molécules de polymères sont plutôt persévérantes. Comme elles considèrent que leur rythme de déplacement est le bon, elles estiment devoir l'imposer aux molécules de dissolvant. Alors comment les grosses molécules de polymères vont-elles imposer leur "slow" aux molécules de dissolvant plus " rockeuses " ? Pour comprendre, il faut s'imaginer le départ pour un " méga " week-end de trois jours. Vous quittez votre agglomération polluée, pour un week-end " au vert ", avec vos acolytes préférés. Vous vous entassez dans votre décapotable avec le matos adéquat et en route pour l'aventure. Mais juste après vous être engagé sue la voie rapide vous sentez votre ardeur s'estomper. Le vent qui au départ soufflait furieusement dans votre chevelure, laisse maintenant sa place à une faible brise d'été, aussi faible que la vitesse de votre décapotable d'ailleurs. Votre moteur tousse et pour le laisser respirer, vous devez rétrograder en quatrième, puis en troisième réduisant ainsi votre vitesse de croisière. "Et quelle vitesse !!!" Votre renommée d'as du volant en prend un coup lorsque un bref coup d'oeil sur le compteur vous indique un dérisoire 50 Km/h, et pour cause :
A perte de vue, une longue file de décapotables roulant piteusement en troisième , vous apercevez quelques mètres devant vous, sur une grande housse de protection d'une roue de secours, "la Famille Bidochon de Brieconterobert vous salue". Cette housse de protection est fixée au dos d'un immense camping-car, couvert d'autocollants faisant l'éloge de beaucoup de ses périples passés comme, bien vivre dans le Cantal, Bretagne - campagne et "Si le coucou chante en Mai, c'est qu'Avril est passé". L'énorme camping car, fumant, visiblement plein à craquer, avance péniblement à une allure qui ferait se tordre de rire le plus lent des escargots. Avec une amère résignation, vous acceptez l'idée que vous arriverez tardivement à votre destination.
C'est comme ça aussi avec les polymères et les petites molécules. L'énorme camping car se déplaçant lentement sur la voie rapide, ralentit TOUT le trafic de l'autoroute. Les grosses molécules de polymères essayent d'emprunter les mêmes voies que les petites molécules de dissolvant. Donc la solution entière se déplace plus lentement et devient plus visqueuse. Mais les molécules de polymère peuvent avoir d'autres actions que le seul blocage des mouvements des petites molécules. Elles les ralentissent aussi grâce aux forces intermoléculaires. S'il y a des forces d'attraction secondaires entre le polymère et les molécules de dissolvant, ces dernières peuvent s'attacher au polymère. Quand cela arrive, les molécules de dissolvant se déplacent plus ou moins avec le polymère et bien sûr, elles se déplacent alors à la même vitesse "d'escargot". Pour vous aider à comprendre, imaginez un petit astéroïde, impétueux qui en traversant l'espace est capturé par la gravité d'une grande planète et devient son satellite. De la même manière, une molécule de dissolvant, venant trop prés d'une molécule de polymère, sera capturée et deviendra "un de ses satellite".
Ok, les polymères rendent les solutions plus visqueuses. Yoouupppiiiiieeee. Mais qu'est-ce que tout cela vient faire dans la mesure du poids moléculaire ?
Cet effet d'épaississant, va nous permettre d'estimer le poids moléculaire à cause d'un fait simple : Plus le poids moléculaire est élevé, plus visqueuse sera la solution de polymère. "Ca tient la route, non". Lorsque un polymère possède un haut poids moléculaire, il occupe également un grand volume hydrodynamique; c'est-à-dire le volume total que le polymère occupe dans la solution. Plus la molécule de polymère sera grande, plus elle pourra bloquer les mouvements des petites molécules de dissolvant. En d'autres termes, elles pourront bloquer encore plus de voies sur l'autoroute. De la même façon, les forces d'attractions secondaires seront elles aussi plus importantes. Vous rappelez-vous du principe d'addition des forces inter-moléculaires ? En résumé, plus le poids moléculaire sera élevé, plus les molécules de dissolvant seront fortement liées au polymère. Cela renforcera le phénomène de ralentissement des molécules de dissolvant.
Pour la plupart des polymères, il y a un rapport défini entre le poids moléculaire et la viscosité. Ainsi, en mesurant la viscosité nous pouvons obtenir le poids moléculaire. Et c'est justement que nous allons faire maintenant, mesurer la viscosité d'un polymère en solution.
On y arrive …
Mesure de la viscosité d'un polymère en solution
Comment mesurons-nous la viscosité d'un polymère en solution ? C'est assez simple. Nous avons juste besoin d'un tube, qui ressemble à celui de l'image ci-dessous et nous allons mesurer le temps nécessaire à la solution pour traverser ce tube.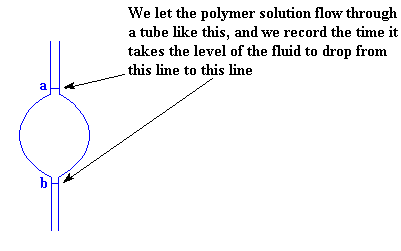
Pour nous assurer que nous mesurons le même volume chaque fois, nous mesurons le temps que prend la solution pour que son niveau baisse de la première ligne (marquée a dans l'image) à la deuxième ligne (marquée b). La grande "vessie" présente entre les deux lignes est nécessaire pour augmenter le volume de la mesure. Sans cela, le temps nécessaire à la solution pour baisser de niveau, serait trop rapide pour être mesurée correctement.
Donc, maintenant nous savons comment mesurer le temps (appelé " temps de fuite ") que prend la solution pour traverser le tube, je vous en dirais un peu plus "later". Cependant, nous ne faisons pas qu'une seule mesure, mais nous mesurons le temps de fuite pour des solutions de concentrations différentes. Pour établir des mesures comparatives, nous mesurons aussi le temps de fuite pour le solvant pur, sans polymère dissous.
Alors, que faisons avec ces mesures ? On va commencer par leur donner un Nom, par conséquent le "temps de fuite" du solvant pur, sera identifié par t0. Alors, nous pouvons faire un premier calcul. Nous allons calculer la viscosité des solutions de polymère par rapport à celle du solvant pur. Nous l'obtenons en divisant le "temps de fuite" d'une solution de concentration donnée (nous l'appelons t), par t0 (temps de fuite du solvant pur). Nous l'appellerons " viscosité relative" et elle sera identifiée par la lettre grecque h.
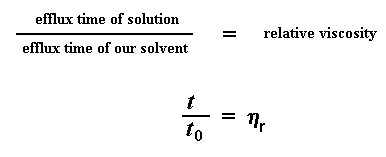
Nous allons utiliser la viscosité relative dans un instant, mais d'abord nous allons faire un peu plus de mathématiques avec le "temps de fuite". Cette fois - ci, nous allons diviser la différence des deux "temps de fuite" (polymère solvaté - solvant pur), par le "temps de fuite" du solvant pur. Vous me suivez ? Présenté différemment, nous soustrayons le "temps de fuite" du solvant pur t0 au "temps de fuite" du polymère en solution t, puis nous divisons ce résultat par t0. Nous l'appellerons "viscosité spécifique", vous êtes toujours là ? Voici les équations :
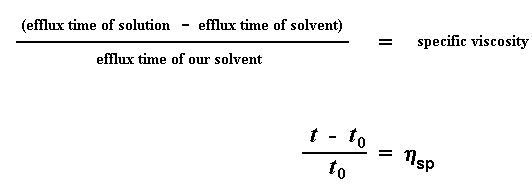
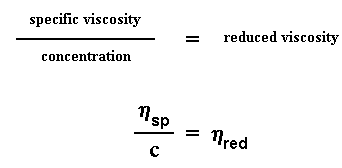
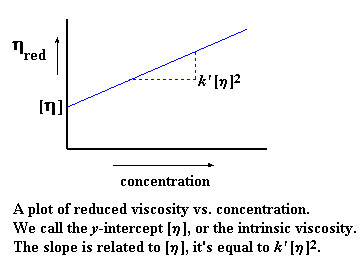
Quand nous traçons ce graphe, nous appelons la pente de la droite k '. Nous extrapolons aussi une valeur de la viscosité intrinsèque à l'intersection de l'axe y pour une valeur de concentration égale à zéro. (Cette viscosité intrinsèque est donc issue d'un calcul ou d'une construction graphique. Il faut noter que la viscosité varie avec la concentration, et la viscosité intrinsèque est une viscosité hypothétique à une hypothétique "concentration zéro".) Voyons où tout ça nous mène à présent. Si vos neurones " rescapés " se souviennent de leurs heures glorieuses passées en cours d'algèbres, ils auront reconnus l'équation d'une pente, qui prend la forme : y = mx + b, où m représente la pente de la droite et b est l'interception avec l'axe y
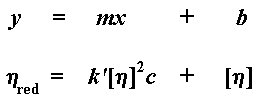
Bien sûr, k ' [n] 2 est notre m, la pente de la ligne; et [n] est notre b, l'interception avec l'axe y. La viscosité intrinsèque est une valeur importante, parce que c'est elle qui nous indique momentanément le poids moléculaire.
Mais à présent, vous souhaitez peut-être prendre une pause et dévorer un casse-croûte bien mérité, et une boisson ; à tout de suite.
Vous êtes de retour ? Évidemment, si non vous ne liriez pas cela. Avant que nous calculions le poids moléculaire à partir de la viscosité intrinsèque, je dois vous indiquer une deuxième façon de calculer la viscosité intrinsèque. Vous souvenez-vous de la viscosité relative ? Je vous ai dit que nous l'utiliserions plus tard et c'est justement ce que nous allons faire maintenant. Prenons le logarithme de la viscosité relative et divisons le, par le pourcentage de la concentration de la solution que nous avons mesurée. Cela nous donne un nombre que nous appellerons, "viscosité inhérente"
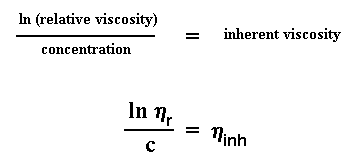
Maintenant, comme pour la viscosité réduite, il y a une "viscosité inhérente" différente pour chaque concentration que vous mesurez. Ainsi, nous pouvons tracer un graphe avec les valeurs de " viscosité inhérente " sur l'axe des ordonnées et le pourcentage de la concentration sur l'axe des abscisses. Alors nous obtenons un graphe qui ressemble à cela :
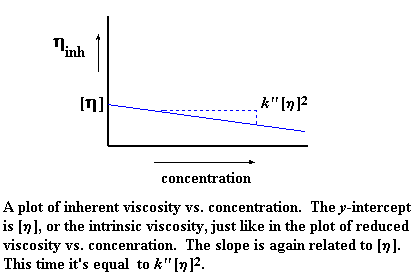
De nouveau, [n] représente l'interception de notre droite avec l'axe y, mais notre pente est cette fois-ci différente, c'est k "[n] 2. Oui, notre graphe est de nouveau une droite inclinée, définie par une équation qui prend la forme suivante :
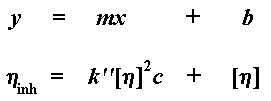
Désormais, nous mesurerons notre "viscosité intrinsèque" en utilisant les deux méthodes. Si elles sont proportionnelles, nous savons que l'expérimentation est correcte. Nous réunirons les deux droites (issues des deux méthodes) sur un même graphe (avec une interception commune de l'axe y) pour obtenir ceci :
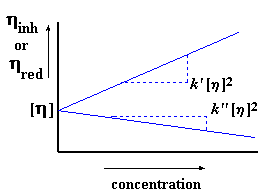
On peut aussi s'assurer que l'expérimentation est correcte en vérifiant que : k ' - k " = 0.5
Nous avons fait un nombre de calculs incroyable jusqu'ici, mais nous n'avons toujours pas obtenu le poids moléculaire. Allons-nous y parvenir ?
Bien, bien, soyez patient. J'ai dû tourner un peu autour jusque là, parce que nous avions besoin de la "viscosité intrinsèque" [n] pour calculer le poids moléculaire. Nous le calculons maintenant avec une simple équation :
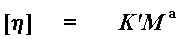
Elle est aussi appelée, équation de Mark - Houwink. Le "M" est ce que nous appelons la viscosité du poids moléculaire moyen (au moins égal à 1), K ' et a, sont les constantes de Mark - Houwink. Il existe des valeurs spécifiques de ces constantes pour chacune des combinaisons, dissolvant - polymère. Donc vous devez connaître celles correspondantes à votre combinaison dissolvant - polymère pour obtenir une mesure précise du poids moléculaire. Cela signifie que vous ne pouvez pas obtenir une bonne mesure si vous mesurez un polymère que vous venez juste d'inventer et pour lequel les constantes de Mark-Houwink ne sont pas disponibles. Mais cela pourra toujours vous donner une idée qualitative du poids moléculaire (élevé ou faible). Le simple fait d'obtenir une "viscosité intrinsèque" peut vous indiquer aussi beaucoup. Parfois, ce sera la seule méthode qui vous permettra d'affirmer que ce que vous venez de fabriquer est effectivement un polymère.
Chromatographie par Perméation de Gel

 Retour au sommaire du
Niveau Cinq
Retour au sommaire du
Niveau Cinq