

La polimerizzazione catalizzata da metalloceni sta portando grande subbuglio nel settore della plastica. Sta creando subbuglio in quanto si tratta della cosa più clamorosa che riguarda i polimeri vinilici dopo l'invenzione della polimerizzazione di Ziegler-Natta. Dunque quali sono i commenti e le discussioni su questo argomento? La ragione di tutto questo mormorio è che la polimerizzazione catalizzata da metalloceni permette di ottenere un polietilene che può fermare i proiettili! Questo nuovo polietilene è migliore del Kevlar per produrre giubbotti antiproiettile. Questo è possibile in quanto ha un peso molecolare molto più elevato del polietilene realizzato con il processo Ziegler-Natta. Quanto elevato, vi chiederete? Fino a sei o sette milioni, è veramente elevato!
Ed oltre ad un alto peso molecolare, c'è di più. E' anche utile per ottenere polimeri con una tatticità molto specifiche. Può essere regolato per formare polimeri isotattici e sindiotattici a seconda delle esigenze.
Lo so, non posso continuare ad evitare questa domanda. Posso dire semplicemente, la polimerizzazione metallocenica è la polimerizzazione catalizzata da metalloceni.
Sapevo che mi avreste fatto questa domanda. Di nuovo posso solo dirvi che un metallocene è uno ione di un metallo con carica positiva che si trova in mezzo tra due ciclopentadienil-anioni con carica negativa.
Che mente inquisitoria avete! E la vostra capacità di indagare deve essere premiata! Vi dirò che il ciclopentadienil-anione (o ciclopentedienuro) è un eccezionale piccolo ione, formato da una piccola molecola chiamata ciclopentadiene. Penso che vi starete chiedendo che cosa è quindi ho realizzato un piccolo disegno per mostrarvelo.
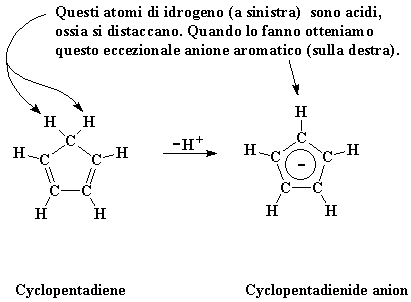
Noterete l'atomo di carbonio in alto con due atomi di idrogeno, mentre i restanti ne hanno uno. Questi due atomi di idrogeno sono acidi, ossia si staccano facilmente. Quando si verifica questa condizione l'atomo di carbonio lascia indietro i suoi elettroni leganti. Quindi l'atomo di carbonio che rimane ha ora un'ulteriore coppia di elettroni.
Non è antipatico avere elettroni in più senza sapere cosa farne?
Ma non è questo il caso del ciclopentadiene, non abbiate paura! Vedete quei due legami doppi sulla molecola? Ognuno di essi ha due elettroni, ricordate, che in tutto fa quattro. Aggiungete quei due elettroni in più all'atomo di carbonio che ha perso l'atomo di idrogeno e ne avrete sei.
Questo è importante. Sei elettroni in una molecola ad anello come questa formeranno un anello aromatico. Se avete studiato chimica organica dovreste sapere cosa significa, bene! Se non lo avete fatto sappiate che significa che l'anello in questa forma anionica sarà molto stabile.
Capito?
Questi ioni ciclopentadienuri hanno carica -1, per cui quando sopraggiunge un catione, come Fe con carica +2, due degli anioni formeranno un sandwich con il ferro. Questo sandwich ferro viene chiamato ferrocene.

Talvolta viene coinvolto un metallo con una carica maggiore, come lo zirconio con carica +4. Per bilanciare la carica, lo zirconio legherà due ioni cloruro, ognuno con carica -1, per formare un composto naturale.
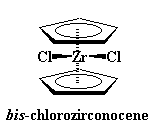
Gli zirconioceni sono leggermente diversi dal ferrocene. Vedete quei leganti extra, gli atomi di cloro, richiedono spazio. E' difficile per loro schiacciarsi tra i due anelli ciclopentadienilici. Quindi per fare spazio agli atomi di cloro, gli anelli si inclinano uno rispetto all'altro, aprendosi come una valva di mollusco. Questo fa in modo che gli atomi di cloro possano respirare. Guardate questa figura che rappresenta questa inclinazione:
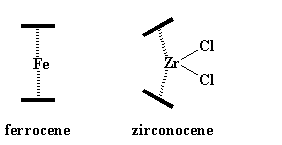
ferrocene zirconocene
Come potete vedere gli anelli ciclopentadienilici, rappresentati come linee scure spesse, sono paralleli uno all'altro nel ferrocene, mentre formano un angolo nello zirconocene. L'inclinazione si verifica ogni volta che un metallocene ha più di due anelli ciclopentadienilici come leganti.
Possiamo usare alcuni derivati di bis-clorozirconoceni per formare polimeri. Prendete questo ad esempio:
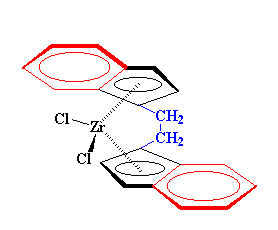
E' diverso dal bis-clorozirconocene in quanto ogni anello ciclopentadienilico ha una altro anello aromaticom, a sei carboni, fuso insieme ad esso, rappresentato in rosso. Questo sistema a due anelli formato da anelli ciclopentadienilici uniti ad un anello fenilico viene chiamato legante indenilico. Inoltre c'è un ponte etilenico, disegnato in blu, che unisce gli anelli ciclopentadienilico superiori ed inferiori. Queste due caratteristiche fanno si che questo composto sia un grande catalizzatore per ottenere i polimeri isotattici. Vedete, quegli enormi leganti indenilici, puntati in direzioni opposte, guidano i monomeri in ingresso in modo che possano reagire solo quando sono rivolti nella direzione corretta per dare polimeri isotattici. Quel ponte etilenico mantiene al loro posto i due anelli indenilici. Senza ponte, potrebbero rigirarsi e non rimanere posizionati nella direzione corretta per dirigere la polimerizzazione isotattica.
Abbiamo parlato dei metalloceni e abbiamo accennato a come possano formare polimeri con tatticità specifica. Ma non abbiamo parlato di come funziona effettivamente la polimerizzazione. Non temete, ecco quello di cui parleremo adesso. Per fare in modo che il nostro complesso zirconocenico catalizzi una polimerizzazione la prima cosa da fare è aggiungere un pizzico di un composto chiamato MAO. Questo composto non è stato scoperto dall'ultimo dittatore cinese Mao Zedong come qualcuno può aver immaginato. MAO infatti è il nome abbreviato dell'allumossano di metile Non lo sapevate, lo stesso MAO è un polimero, con una struttura come questa:
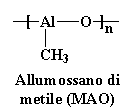
Allumossano di metile (MAO)
Si tratta di un polimero insolito poiché presenta atomi di metallo nella catena principale. Ma siamo più interessati a cosa fa che non a cosa è. Mettiamo un pochino di questa sostanza, per un pochino intendo tra un centesimo e un decimo percentuale della totalità del catalizzatore. Il MAO sta per combinare qualche cosa con gli atomi di cloro del nostro zirconocene. Vedete, questi atomi di cloro sono quelli che chiamiamo instabili. Ossia a loro piace staccarsi dagli zirconoceni. Così il MAO può sostituirli con alcuni dei suoi gruppi metilici. Abbiamo a questo punto un catalizzatore come questo:
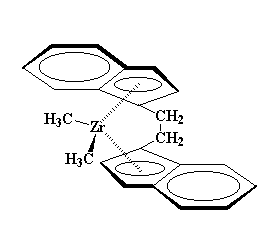
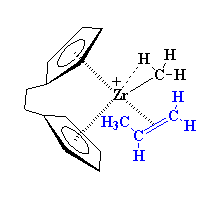
Non lo sapevate, anche i gruppi metilici possono staccarsi. Quando uno di loro si stacca, otteniamo un complesso come questo

Noterete nella figura che lo zirconio con carica positiva è stabile poiché gli elettroni del gruppo carbonio-idrogeno sono condivisi con lo zirconio. Questa viene chiamata associazione a -agostica. Allo zirconio comunque mancano ancora degli elettroni. Ha bisogno di ben più di un'associazione agostica per soddisfarlo. Ecco da dove arriva il nostro monomero olefinico. Immaginate un alchene come il propilene. Il suo doppio legame carbonio-carbonio viene caricato con elettroni da ripartire.
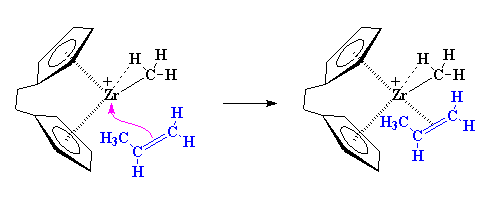
Ma la complessazione è un processo molto delicato, non così semplice come sembra dalla figura. Se sapete già come funziona potete passare alla sezione successiva e passare direttamente alla polimerizzazione. Altrimenti leggete qui di seguito come funziona la complessazione.
Note sulla complessazione metallo-alchene
Passate direttamente alla polimerizzazione
Adesso inizia a diventare
interessante. Supponete a questo punto appia un monomero vinilico, ad esempio,
una molecola di propilene. Lo zirconio sarà contento. Per capirne
il motivo, diamo un'occhiata al monomero vinilico, più specificatamente
al suo legame doppio. Un doppio legame carbonio-carbonio, è composto
da un legame s
e da un legame p. Diamo un'occhiata più da vicino a questo legame p.
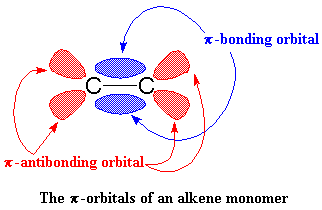
Guardate la figura e vedrete
che il legame p è formato da due orbitali p. Uno è l'orbitale di legame-p (rappresentato in blu) e l'altro è l'orbitale di antilegame-p (rappresentato in rosso).
Ci sono due lobi tra gli
atomi di carbonio, l'orbitale di antilegame-p ha quattro lobi, che si allontanano dagli atomi di carbonio. Normalmente la coppia di elettroni rimane nell'orbitale di legame-p. L'orbitale di antilegame-p ha troppa energia quindi in condizioni normali è vuoto.
Guardiamo di nuovo lo zirconio
per un attimo. Questa figura mostra lo zirconio e due dei suoi orbitali-d.
Effettivamente lo zirconio ha cinque orbitali-d, ma ne mostriamo solo due
adesso per maggior chiarezza.
Uno degli orbitali-d che
abbiamo rappresentato è quello vuoto. E' formato da lobi verdi.
I lobi rosa sono gli orbitali-d pieni. L'orbitale-d vuoto è in cerca
di una coppia di elettroni e sa dove trovarli. Sa che l'orbitale di legame
-p dell'alchene
ha una coppia che potrà condividere. Quindi l'orbitale-p di legame dell'alchene e l'orbitale-d dello zirconio si uniscono e condividono
una coppia di elettroni.
Ma una volta uniti, l'altro orbitale-d si avvicina molto all'orbitale di antilegame-p vuoto. Quindi anche l'orbitale-d e gli orbitali di antilegame-p hanno in comune una coppia di elettroni.
Gli
elettroni di uno degli orbitali-d pieni può scivolare nell'orbitale
di antilegame-p dell'alchene, rendendo il complesso zirconio alchene più resistente
Questa ulteriore condivisione
di elettroni rende ancora più resistente il complesso. Questa complessazione
tra l'alchene e lo zirconio prepara le cose per la fase successiva della
polimerizzazione.
La natura precisa del complesso
tra lo zirconio ed il propilene è complicata. Per semplificare le
cose da ora in poi lo rappresenteremo come abbiamo fatto prima:
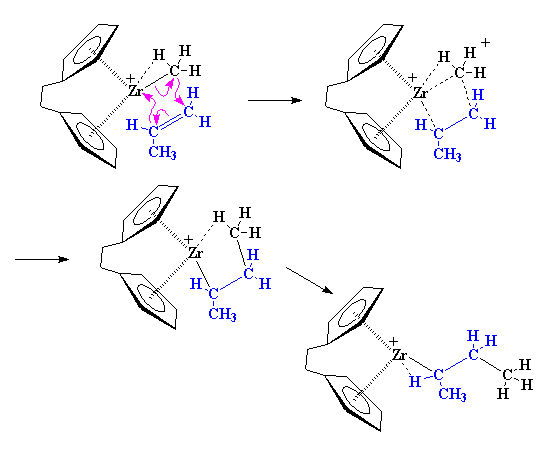
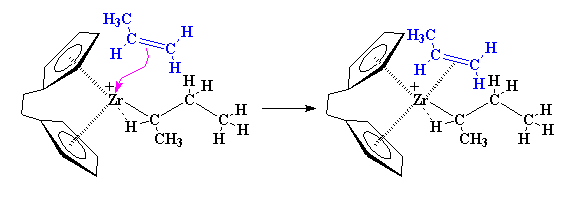
Questa complessazione stabilizza lo zirconio ma non per molto. Vedete, quando
si forma questo complesso, può disporsi in una nuova forma. Gli
elettroni iniziano a muoversi, come si può vedere nella figura qui
sotto. Gli elettroni del legame di carbonio zirconio-metile si spostano
per formare un legame tra il carbonio metilico ed uno degli atomi di carbonio
del propilene. Nel frattempo, la coppia di elettroni che ha formato il
complesso metallo-alchene si sposta per formare un legame complementare
tra lo zirconio ed uno degli atomi di carbonio del propilene.
Come potete vedere nella figura,
questo avviene tramite uno stato di transizione a quattro elementi. Inoltre
lo zirconio termina proprio come ha iniziato, senza un legante, ma con
una associazione agostica con un legame C-H del monomero di propilene.
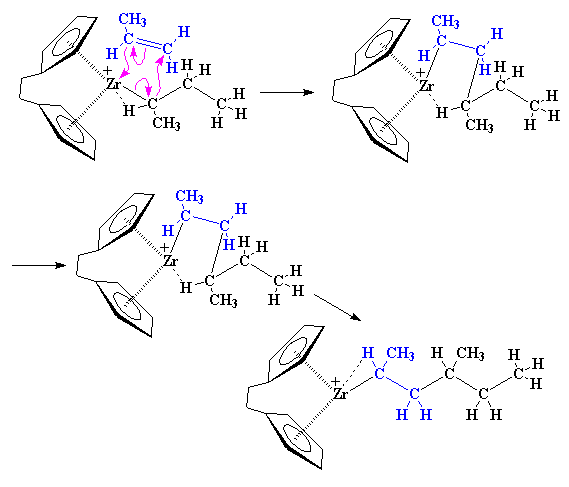
Tornando da dove abbiamo
iniziato, può sopraggiungere un altro monomero di propilene e reagire
proprio come ha fatto il primo.
Il polipropilene si coordina
con lo zirconio … e gli elettroni si mescolano:
Alla fine si è aggiunto
alla catena un secondo monomero di propilene. Notate che abbiamo terminato
con un polimero isotattico; i gruppi metilici sono sempre sullo stesso
lato della catena polimerica. Come potete prevedere il successivo monomero
si coordinerà con lo zirconio sullo stesso lato del primo. dell'approccio.
Ogni monomero che si aggiunge prosegue nella stessa direzione.
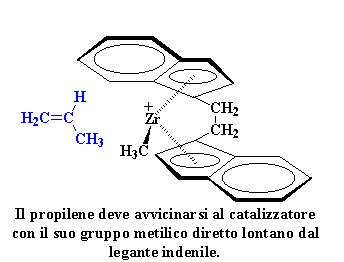
Quindi perché otteniamo
un polimero isotattico? Diamo un'occhiata al catalizzatore ed alla molecola
di propilene monomero in arrivo. Come potete notare il propilene
monomero, si avvicina sempre al catalizzatore con il suo gruppo metilico
diretto lontano dal legante indenilico.
Se i gruppi metilici fossero
diretti verso il legante indenilico, i due si urterebbero, impedendo al
propilene di avvicinarsi allo zirconio per formare un complesso. Quindi
solo quando il gruppo metilico è direzionato lontano dal legante
indenilico il propilene può formare un complesso con lo zirconio.
Quando si aggiunge il secondo
monomero, lo stesso deve avvicinarsi dall'altro lato, e anch'esso deve
dirigere il suo gruppo metilico lontano dall'anello indenilico.
Questo significa che il gruppo
metilico non è indirizzato verso il basso. Poiché il secondo
propilene si aggiunge dal lato opposto a quello del primo, deve essere
indirizzato nella direzione opposta se i gruppi metilici terminano sullo
stesso lato della catena polimerica. (Pensateci un attimo e capirete che
ha senso).
Ragazzi, ora sorge spontanea
una domanda. Sapendo perché questo catalizzatore forma polipropilene
isotattico, quale tipo di catalizzatore darà il polipropilene sindiotattico?
Siete riusciti ad immaginarlo?
E' un catalizzatore come come questo ragazzaccio, analizzato dai due chimici Ewen e Asanuma:
Credo che possiate capire
perché otteniamo la polimerizzazione sindiotattica da questo catalizzatore.
I monomeri che si susseguono si avvicinano dai lati opposti del catalizzatore
, ma puntano sempre i loro gruppi metilici verso l'alto. In questo modo
i gruppi metilici terminano in modo alternato sulla catena polimerica.
I catalizzatori metalloceni
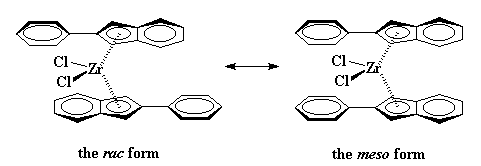
possono fare cose anche più strane. Prendiamo ad esempio il bis(2-fenilindenil)zirconio
dicloruro. Questo metallocene, come potete vedere qui di seguito non presenta
ponti tra i due anelli indenili. Questo significa che i due anelli possono
girare liberamente. Talvolta gli anelli saranno posizionati nella stesse
direzione. Questa è la forma "racemo."
Altre volte gli anelli saranno posizionati nella stessa direzione. Questa
è la forma meso. Il composto per un po’ rimane nella forma racemica,
poi si gira e diventa una forma "meso". Dopo un po’ ritornerà di
nuovo alla forma precedente. Questo continua a verificarsi più e
più volte.
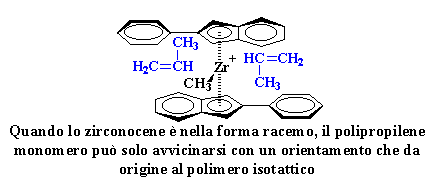
Cosa significa questo per
la nostra polimerizzazione ? Significa che accadrà una cosa veramente
strana. Quando lo zirconocene è nella forma racemo il monomero di
polipropilene può solo avvicinarsi con un orientamento che darà
origine ad un polipropilene isotattico.
Ricordatevi che lo zirconocene
passa da una forma all'altra in continuazione. Agisce così mentre
è in corso la polimerizzazione. Questo significa che la stessa catena
polimerica finirà con blocchi atattici e blocchi isotattici, come
questo:
Questo tipo di polipropilene
viene chiamato polipropilene elastomerico perché in effetti è
un elastomero.
Ma c'è di più.
E' un tipo di elastomero speciale chiamato elastomero termoplastico. Per
saperne di più sul perché questo stravagante tipo di polipropilene
si comporta come un elastomero, visitate la pagina del polipropilene e
la pagina dell'elastomero termoplastico!
Complessi metallo-alchene

Lo zirconio ha cinque orbitali-d,
ma ne mostriamo sono due; quello pieno è rosa, quello vuoto di cui
abbiamo parlato è verde.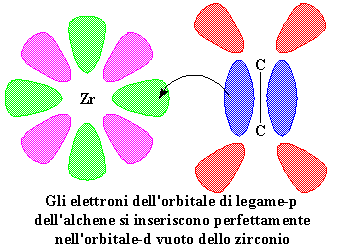
Gli
elettroni dell'orbitale di legame-p dell'alchene
si inseriscono perfettamente nell'orbitale-d vuoto dello zirconio.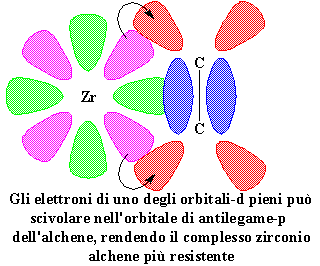
LA POLIMERIZZAZIONE
Il propilene deve
avvicinarsi al catalizzatore con il suo gruppo metilico diretto lontano
dal legante indenile.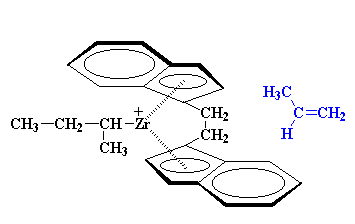
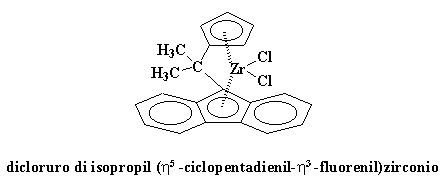
dicloruro di isopropil (h5-ciclopentadienil-h3-fluorenil)zirconioCRISI DI IDENTITA'
Quando lo zirconocene
è nella forma racemo, il polipropilene monomero può solo
avvicinarsi con un orientamento che da origine al polimero isotattico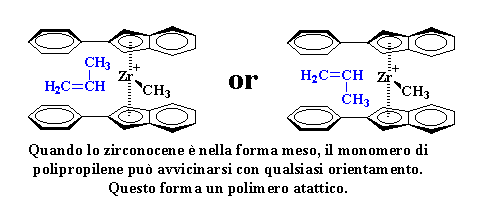
Quando lo zirconocene è
nella forma meso, il monomero di polipropilene può avvicinarsi con
qualsiasi orientamento. Questo forma un polimero atattico.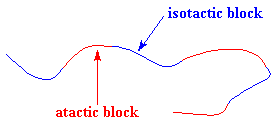
 Ritorna
all'Indice del Quarto Piano
Ritorna
all'Indice del Quarto Piano
 Ritorna
all'Indice della Macrogalleria
Ritorna
all'Indice della Macrogalleria